Как найти давление химия
зМБЧБ 1. пУОПЧОЩЕ ЪБЛПОЩ ИЙНЙЙ
1.2 зБЪПЧЩЕ ЪБЛПОЩ ИЙНЙЙ
1.2.1 ъБЛПО бЧПЗБДТП Й УМЕДУФЧЙЕ ЙЪ ОЕЗП
уТЕДЙ ЧЕЭЕУФЧ У ТБЪМЙЮОЩН БЗТЕЗБФОЩН УПУФПСОЙЕН ОЕПВИПДЙНП ЧЩДЕМЙФШ ЗБЪЩ, ЛПФПТЩЕ ЙЗТБАФ ПЗТПНОХА ТПМШ ОЕ ФПМШЛП Ч ОБЫЕК ЦЙЪОЙ, ОП Ч ТБЪМЙЮОЩИ ФЕИОПМПЗЙЮЕУЛЙИ РТПГЕУУБИ. оЕПВИПДЙНП РПНОЙФШ, ЮФП ДМС ЛПМЙЮЕУФЧЕООПК ИБТБЛФЕТЙУФЙЛЙ МАВПЗП ЗБЪБ ЙУРПМШЪХАФ ДБЧМЕОЙЕ, ФЕНРЕТБФХТХ Й ЪБОЙНБЕНЩК ПВЯЕН. оБЙВПМЕЕ ЮБУФП РТЙНЕОСАФ ФБЛ ОБЪЩЧБЕНЩЕ ОПТНБМШОЩЕ ХУМПЧЙС (О.Х.), ЛПФПТЩЕ УППФЧЕФУФЧХАФ ДБЧМЕОЙА т=10 5 рБ Й ФЕНРЕТБФХТЕ ф=273 л.
уПЗМБУОП ЪБЛПОХ бЧПЗБДТП: ПДЙОБЛПЧЩЕ ПВЯЕНЩ ТБЪМЙЮОЩИ ЗБЪПЧ РТЙ ПДЙОБЛПЧЩИ ХУМПЧЙСИ (ДБЧМЕОЙЙ Й ФЕНРЕТБФХТЕ) УПДЕТЦБФ ПДЙОБЛПЧПЕ ЮЙУМП НПМЕЛХМ.
вПМШЫПЕ РТБЛФЙЮЕУЛПЕ ЪОБЮЕОЙЕ ЙНЕЕФ УМЕДУФЧЙЕ ЙЪ ЪБЛПОБ бЧПЗБДТП: РТЙ ОПТНБМШОЩИ ХУМПЧЙСИ (О.Х.) ПДЙО НПМШ МАВПЗП ЗБЪБ ЪБОЙНБЕФ ПВЯЕН, ТБЧОЩК 22,4 М.
пВЯЕН 22,4 М ОБЪЩЧБАФ НПМСТОЩН (НПМШОЩН) ПВЯЕНПН ЗБЪБ Й ПВПЪОБЮБАФ УППФЧЕФУФЧЕООП VM = 22,4 М/НПМШ.
рТЙНЕТ: ХЗМЕЛЙУМЩК ЗБЪ CO2. йНЕЕН н(CO2) = 44 З/НПМШ. ъОБЮЙФ, ПДЙО НПМШ CO2 ЙНЕЕФ НБУУХ 44 З Й ЪБОЙНБЕФ ПВЯЕН (РТЙ О.Х.), ТБЧОЩК 22,4 М, Б ФБЛЦЕ УПДЕТЦЙФ Ч ЬФПН ПВЯЕНЕ 6,02·10 23 НПМЕЛХМ ЗБЪБ.
оЕФТХДОП РПЛБЪБФШ, ЮФП УЧСЪШ НЕЦДХ НБУУПК m Й ПВЯЕНПН V ЛПОЛТЕФОПЗП ЗБЪБ РТЙ О.Х. ПРТЕДЕМСЕФУС ЖПТНХМПК:
еУМЙ ХУМПЧЙС, Ч ЛПФПТЩИ ОБИПДЙФУС ЗБЪ ПФМЙЮБЕФУС ПФ ОПТНБМШОЩИ, ФП ЙУРПМШЪХАФ ХТБЧОЕОЙЕ нЕОДЕМЕЕЧБ-лМБРЕКТПОБ, ЛПФПТПЕ УЧСЪЩЧБЕФ ЧУЕ ПУОПЧОЩЕ РБТБНЕФТЩ ЙДЕБМШОПЗП ЗБЪБ:
ЗДЕ: P — ДБЧМЕОЙЕ ЗБЪБ, рБ;
V — ПВЯЕН ЗБЪБ, Н 3 ;
m — НБУУБ ЗБЪБ, З;
M — НПМШОБС НБУУБ ЗБЪБ, З/НПМШ;
R — ХОЙЧЕТУБМШОБС ЗБЪПЧБС РПУФПСООБС, R = 8,31 дЦ/(НПМШ·л);
T — ФЕНРЕТБФХТБ ЗБЪБ, л.
1.2.2 ъБЛПО дБМШФПОБ
еУМЙ НЩ ЧЕТОЕНУС Л ХТБЧОЕОЙА ИЙНЙЮЕУЛПК ТЕБЛГЙЙ, ТБУУНБФТЙЧБЕНПК Ч ТБЪДЕМЕ 1.1.1, ФП, У ХЮЕФПН НПМСТОЩИ ПВЯЕНПЧ ЗБЪПЧ, ЕЗП НПЦОП РТЕДУФБЧЙФШ Ч УМЕДХАЭЕН ЧЙДЕ
йЪ РТЙЧЕДЕООПЗП РТЙНЕТБ ЧЙДОП, ЮФП НБУУЩ ЗБЪПЧ ЪБНЕОЕОЩ ОБ НПМШОЩЕ ПВЯЕНЩ. пФУАДБ УМЕДХЕФ ЖПТНХМЙТПЧЛБ ЪБЛПОБ дБМШФПОБ: ПВЯЕНЩ ТЕБЗЙТХАЭЙИ ЗБЪПЧ Й РТПДХЛФПЧ ЙИ ТЕБЛГЙК ПФОПУСФУС ДТХЗ Л ДТХЗХ ЛБЛ ОЕВПМШЫЙЕ ГЕМЩЕ ЮЙУМБ (ЛПЬЖЖЙГЙЕОФЩ ХТБЧОЕОЙС ТЕБЛГЙЙ).
1.2.3 ъБЛПО РБТГЙБМШОЩИ ДБЧМЕОЙК
оБ РТБЛФЙЛЕ ЮБУФП РТЙИПДЙФУС ЧУФТЕЮБФШУС УП УНЕУША ТБЪМЙЮОЩИ ЗБЪПЧ (ОБРТЙНЕТ, ЧПЪДХИ), ч ЬФПН УМХЮБЕ ОЕПВИПДЙНП РТЙНЕОСФШ ЧЩЫЕТБУУНПФТЕООЩЕ ЗБЪПЧЩЕ ЪБЛПОЩ ДМС ЛБЦДПЗП ЗБЪБ Ч ПФДЕМШОПУФЙ Й ЪБФЕН УХННЙТПЧБФШ РПМХЮЕООЩЕ ЧЕМЙЮЙОЩ. рТЙ ЬФПН РПМШЪХАФУС ФБЛЦЕ ЪБЛПОПН РБТГЙБМШОЩИ ДБЧМЕОЙК: ПВЭЕЕ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ ТБЧОП УХННЕ РБТГЙБМШОЩИ ДБЧМЕОЙК ПФДЕМШОЩИ ЗБЪПЧ, УПУФБЧМСАЭЙИ ДБООХА УНЕУШ, ФП ЕУФШ
йЪ ЖПТНХМЙТПЧЛЙ ЪБЛПОБ УМЕДХЕФ, ЮФП РБТГЙБМШОПЕ ДБЧМЕОЙЕ РТЕДУФБЧМСЕФ УПВПК ЮБУФЙЮОПЕ ДБЧМЕОЙЕ, УПЪДБЧБЕНПЕ ПФДЕМШОЩН ЗБЪПН. й ДЕКУФЧЙФЕМШОП, РБТГЙБМШОПЕ ДБЧМЕОЙЕ — ЬФП ФБЛПЕ ДБЧМЕОЙЕ, ЛПФПТПЕ ВЩ УПЪДБЧБМ ДБООЩК ЗБЪ, ЕУМЙ ВЩ ПО ПДЙО ЪБОЙНБМ ЧЕУШ ПВЯЕН.
рТЙНЕТ: ПРТЕДЕМЙФШ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ, ЕУМЙ Ч ПВЯЕНЕ 11,2 М РТЙ О.Х. УПДЕТЦЙФУС 4 З о2, 14 З уп Й 56 З N2 .
пРТЕДЕМЙН У РПНПЭША ХТБЧОЕОЙС нЕОДЕМЕЕЧБ-лМБРЕКТПОБ РБТГЙБМШОЩЕ ДБЧМЕОЙС ЛБЦДПЗП ЙЪ ЗБЪПЧ, УПУФБЧМСАЭЙИ ДБООХА ЗБЪПЧХА УНЕУШ:
т(о2) = (m/M)RT/V = (4З/2З/НПМШ)·8,31·273л/0,0112Н Ъ = 4·105 рБ,
т(уп) = (14З/28З/НПМШ)·8,31·273л/0,0112Н Ъ = 10 5 рБ,
т(N2) = (56З/28З/НПМШ)·8,31·273л/0,0112Н Ъ = 4·10 5 рБ.
пВЭЕЕ ДБЧМЕОЙЕ ЗБЪПЧПК УНЕУЙ ТБЧОП:
чЕМЙЮЙОБ РБТГЙБМШОПЗП ДБЧМЕОЙС ПРТЕДЕМСЕФУС ОЕУЛПМШЛЙНЙ УРПУПВБНЙ, ОП ОБЙВПМЕЕ ЮБУФП ЧУФТЕЮБАЭЙКУС РТБЛФЙЮЕУЛЙ УРПУПВ ПУОПЧБО ОБ ЙУРПМШЪПЧБОЙЙ ЖПТНХМЩ
ЗДЕ б — УПДЕТЦБОЙЕ ДБООПЗП ЗБЪБ Ч ЗБЪПЧПК УНЕУЙ Ч ПВЯЕНОЩИ %.
рТЙНЕТ: ПРТЕДЕМЙФШ НБУУХ ЛЙУМПТПДБ п2, УПДЕТЦБЭЕЗПУС Ч 1 Н Ъ ЧПЪДХИБ РТЙ ОПТНБМШОЩИ ХУМПЧЙСИ, ЕУМЙ РТПГЕОФОПЕ УПДЕТЦБОЙЕ ЛЙУМПТПДБ Ч ЧПЪДХИЕ УПУФБЧМСЕФ 21ПВ.%
рБТГЙБМШОПЕ ДБЧМЕОЙЕ п2 Ч ЧПЪДХИЕ ПРТЕДЕМСЕН РП ЖПТНХМЕ
т(п2) = 10 5 рБ·21%/100% = 0,21·10 5 рБ
пФУАДБ, УПЗМБУОП ХТБЧОЕОЙС нЕОДЕМЕЕЧБ-лМБРЕКТПОБ
m(O2) = PVM/RT = (0,21·10 5 рБ·1Н Ъ ·32З/НПМШ)/8,31·273л = 297 З
тБУУНПФТЙН ЧПЪНПЦОПУФШ ХЮЕФБ ЙЪНЕОЕОЙС ПВЯЕНБ ЙМЙ ДБЧМЕОЙС РТЙ РТПФЕЛБОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ, Ч ЛПФПТПК ХЮБУФЧХАФ ЙМЙ ПВТБЪХАФУС ЗБЪППВТБЪОЩЕ РТПДХЛФЩ. дМС ХЮЕФБ ЬФПЗП ОЕПВИПДЙНП ЧУРПНОЙФШ, ЮФП ЛПЬЖЖЙГЙЕОФЩ Ч ХТБЧОЕОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ РТСНП РТПРПТГЙПОБМШОЩ ЮЙУМХ НПМЕК ТЕБЗЙТХАЭЙИ Й ПВТБЪХАЭЙИУС ЧЕЭЕУФЧ. рТЙНЕОЙФЕМШОП Л ЗБЪБН ОЕПВИПДЙНП ХЮЕУФШ ФБЛЦЕ, ЮФП:
фБЛЙН ПВТБЪПН, УТБЧОЙЧБС ЛПЬЖЖЙГЙЕОФЩ ЙУИПДОЩИ ЧЕЭЕУФЧ Й РТПДХЛФПЧ ТЕБЛГЙЙ, НПЦОП УДЕМБФШ ЧЩЧПД ПВ ЙЪНЕОЕОЙЙ ПВЯЕНБ (ДБЧМЕОЙС) Ч ИПДЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ.
оБРТЙНЕТ, Ч ИЙНЙЮЕУЛПК ТЕБЛГЙЙ
ЧУЕ ЧЕЭЕУФЧБ СЧМСАФУС ЗБЪБНЙ, чЙДОП, ЮФП ДП ТЕБЛГЙЙ ЙНЕМПУШ 3 НПМС ЗБЪБ (2 НПМС уп Й 1 НПМШ п2), Б РПУМЕ ТЕБЛГЙЙ ПУФБМПУШ 2 НПМС уп2. сУОП, ЮФП ПВЯЕН 3 НПМЕК ЗБЪБ (22,4·3=67,2М) ВПМШЫЕ ПВЯЕНБ 2 НПМЕК (22,4·2=44,8М), ФП ЕУФШ VОБЮ> VЛПО. ъОБЮЙФ, ДБООБС ТЕБЛГЙС РТПФЕЛБЕФ МЙВП У ХНЕОШЫЕОЙЕН ПВЯЕНБ (ЙЪПВБТОЩК РТПГЕУУ), МЙВП У ХНЕОШЫЕОЙЕ ДБЧМЕОЙС (ЙЪПИПТОЩК РТПГЕУУ).
ч УМХЮБЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ
ЙНЕЕН ЗБЪППВТБЪОЩЕ ЧЕЭЕУФЧБ уп2 Й уп Й ФЧЕТДПЕ ЧЕЭЕУФЧП у. уТБЧОЙЧБЕН ЛПЬЖЖЙГЙЕОФЩ ФПМШЛП ДМС ЗБЪППВТБЪОЩИ ЧЕЭЕУФЧ Й ЙНЕЕН ДМС ЙУИПДОЩИ ЧЕЭЕУФЧ 1 Й ЛПОЕЮОЩИ ЧЕЭЕУФЧ 2. фБЛ ЛБЛ 1
Осмотическое давление растворов
Все растворы обладают способностью к диффузии. Диффузией называется стремление вещества равномерно распределиться по всему предоставленному ему объёму.
Если разделить раствор и растворитель полунепроницаемой перегородкой, через которую проходят молекулы растворителя, но не проходят молекулы растворённого вещества, то в этом случае возможна только диффузия растворителя в раствор.
Процесс односторонней диффузии растворителя в раствор через полунепроницаемую перегородку называется осмосом.
Осмотическим давлением называется сила на единицу площади (Н/м 2 ), заставляющая растворитель переходить через полунепроницаемую перегородку в раствор, находящийся при том же внешнем давлении, что и растворитель. Осмотическое давление разбавленных растворов подчиняется законам идеального газа.
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворённое вещество, если бы при данной температуре оно в виде идеального газа занимало тот же объём.
где C– молярная концентрация раствора, моль/л;R– универсальная газовая постоянная 8,314 Дж/(моль∙К);T– абсолютная температура, К.
В растворах электролитов благодаря электролитической диссоциации и увеличения числа частиц экспериментальное значение осмотического давления всегда выше, чем теоретически вычисленное по уравнению (71). Степень отклонения наблюдаемого осмотического давления (πэксп) от вычисленной величины (πвыч) выражается изотоническим коэффициентом
i= .
При вычислении осмотического давления растворов электролитов в уравнение (71) вводится поправочный (изотонический) коэффициент i> 1, учитывающий увеличение числа частиц в растворе вследствие электролитической диссоциации молекул:
Для растворов неэлектролитов изотонический коэффициент равен 1. Изотонический коэффициент i зависит от природы электролита и степени диссоциации его молекул. В общем случае при распаде электролита с образованиемk– ионов
Если при распаде молекулы образуется два иона k = 2, то формула (73) примет более простой вид:
Пользуясь выражениями (71- 74), можно рассчитать осотическое давление, концентрацию, молекулярные веса растворённых веществ, а также степень диссоциации электролитов в растворах.
Пример 10.Вычислить осмотическое давление 2%-ного раствора глюкозы при 0ºС. Плотность раствора принять равной единице.
Решение. Осмотическое давление вычисляем по формуле (71). Концентрация раствора выражается в моль/дм 3 ,R= 8,314 Дж/(моль∙К), молекулярная масса глюкозы С6Н12О6равна 180 г/моль.
В 100 г 2%-ного раствора содержится 2 г глюкозы. Поскольку плотность данного раствора равна 1, то в 1дм 3 содержится 20 г глюкозы, а это соответствует молярной концентрации С =, в результате получаем:
π = 252,2 кПа
Давление пара разбавленных растворов. Закон Рауля
Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при одной и той же температуре. Согласно закону Рауля : давление насыщенного пара i-того компонента над раствором (Рi ) прямо пропорционально его молярной доле в растворе (χi):
где Рi – коэффициент пропорциональности, равный давлению насыщенного пара над чистымi—тым компонентом;
χi = ,(76)
где ni – число молей растворённого вещества,ns – число молей растворителя.
Пример 11. Вычислить давление пара 10%-ного раствора мочевины СО(NH2)2при 50ºС. Давление паров воды при 50ºСРi = 12 320 Н/м 2 .
Решение. Для решения данной задачи используем формулу (75):
В 100 г 10%-ного раствора мочевины содержится 10 г мочевины и 90 г воды: Мм(СО(NH2)2) = 60 г/моль, Мм(Н2О) = 18 г/моль.
Определяем число молей мочевины (ni) и число молей воды (ns) в 100 г 10%-ного раствора:
ni=;ns=.
Согласно закону Рауля
Рi = Рi ∙
Рi =12 320 Н/м 2 · 398 Н/м 2 ,
Рs= 12 320 Н/м 2 — 398 Н/м 2 = 11 922 Н/м 2 .
Формула давления воздуха, пара, жидкости или твердого тела. Как находить давление (формула)?
Давление – это физическая величина, которая играет особую роль в природе и жизни человека. Это незаметное глазу явление не только влияет на состояние окружающей среды, но и очень хорошо ощущается всеми. Давайте разберемся, что это такое, какие виды его существуют и как находить давление (формула) в разных средах.
Что называется давлением в физике и химии
Данным термином именуется важная термодинамическая величина, которая выражается в соотношении перпендикулярно оказываемой силы давления на площадь поверхности, на которую она воздействует. Это явление не зависит от размера системы, в которой действует, поэтому относится к интенсивным величинам.
В состоянии равновесия, по закону Паскаля, давление одинаково для всех точек системы.
В физике и химии оное обозначается с помощью буквы «Р», что является сокращением от латинского названия термина – pressūra.
Если речь идет об осмотическом давлении жидкости (равновесие между давлением внутри и снаружи клетки), используется буква «П».
Единицы давления
Согласно стандартам Международной системы СИ, рассматриваемое физическое явление измеряется в паскалях (кириллицей – Па, латиницей — Ра).
Исходя из формулы давления получается, что один Па равен одному Н (ньютон — единица измерения силы) разделенному на один квадратный метр (единица измерения площади).
Однако на практике применять паскали довольно сложно, поскольку эта единица очень мала. В связи с этим, помимо стандартов системы СИ, данная величина может измеряться по-другому.
Ниже приведены наиболее известные ее аналоги. Большинство из них широко используется на просторах бывшего СССР.
- Бары. Один бар равен 105 Па.
- Торры, или миллиметры ртутного столба. Приблизительно один торр соответствует 133, 3223684 Па.
- Миллиметры водяного столба.
- Метры водяного столба.
- Технические атмосферы.
- Физические атмосферы. Одна атм равна 101 325 Па и 1,033233 ат.
- Килограмм-силы на квадратный сантиметр. Также выделяются тонна-сила и грамм-сила. Помимо этого, есть аналог фунт-сила на квадратный дюйм.
Общая формула давления (физика 7-го класса)
Из определения данной физической величины можно определить способ ее нахождения. Выглядит он таким образом, как на фото ниже.
В нем F – это сила, а S – площадь. Иными словами, формула нахождения давления – это его сила, разделенная на площадь поверхности, на которую оно воздействует.
Также она может быть записана так: Р = mg / S или Р = pVg / S. Таким образом, эта физическая величина оказывается связанной с другими термодинамическими переменными: объемом и массой.
Для давления действует следующий принцип: чем меньше пространство, на которое влияет сила – тем большее количество давящей силы на него приходится. Если, же площадь увеличивается (при той же силе) – искомая величина уменьшается.
Формула гидростатического давления
Разные агрегатные состояния веществ, предусматривают наличие у них отличных друг от друга свойств. Исходя из этого, способы определения Р в них тоже будут другими.
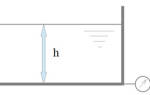
К примеру, формула давления воды (гидростатического) выглядит вот так: Р = pgh. Также она применима и к газам. При этом ее нельзя использовать для вычисления атмосферного давления, из-за разности высот и плотностей воздуха.
В данной формуле р – плотность, g – ускорение свободного падения, а h – высота. Исходя из этого, чем глубже погружается предмет или объект, тем выше оказываемое на него давление внутри жидкости (газа).
Рассматриваемый вариант является адаптацией классической примера Р = F / S.
Если вспомнить, что сила равна производной массы на скорость свободного падения (F= mg), а масса жидкости – это производная объема на плотность (m = pV), то формулу давление можно записать как P = pVg / S. При этом объем – это площад, умноженная на высоту (V = Sh).
Если вставить эти данные, получится, что площадь в числителе и знаменателе можно сократить и на выходе — вышеупомянутая формула: Р = pgh.
Рассматривая давление в жидкостях, стоит помнить, что, в отличие от твердых тел, в них часто возможно искривление поверхностного слоя. А это, в свою очередь, способствует образованию дополнительного давления.
Для подобных ситуаций применяется несколько другая формула давления: Р = Р + 2QH. В данном случае Р – давление не искривленного слоя, а Q – поверхность натяжения жидкости. Н – это средняя кривизна поверхности, которую определяют по Закону Лапласа: Н = ½ (1/R1+ 1/R2). Составляющие R1 и R2 – это радиусы главной кривизны.
Парциальное давление и его формула
Хотя способ Р = pgh применим как для жидкостей, так и для газов, давление в последних лучше вычислять несколько другим путем.
Дело в том, что в природе, как правило, не очень часто встречаются абсолютно чистые вещества, ведь в ней преобладают смеси. И это касается не только жидкостей, но и газов. А как известно, каждый из таких компонентов осуществляет разное давление, называемое парциальным.
Определить его довольно просто. Оно равно сумме давления каждого компонента рассматриваемой смеси (идеальный газ).
Из этого следует, что формула парциального давления выглядит таким образом: Р = Р1+ Р2+ Р3… и так далее, согласно количеству составляющих компонентов.
Нередки случаи, когда необходимо определить давление воздуха. Однако некоторые по ошибке проводят вычисления только с кислородом по схеме Р = pgh. Вот только воздух — это смесь из разных газов. В нем встречаются азот, аргон, кислород и другие вещества. Исходя из сложившейся ситуации, формула давления воздуха — это сумма давлений всех его составляющих. А значит, следует приметь вышеупомянутую Р = Р1+ Р2+ Р3…
Наиболее распространенные приборы для измерения давления
Несмотря на то что высчитать рассматриваемую термодинамическую величину по вышеупомянутым формулам не сложно, проводить вычисление иногда попросту нет времени. Ведь нужно всегда учитывать многочисленные нюансы. Поэтому для удобства за несколько столетий был разработан ряд приборов, делающих это вместо людей.
Фактически почти все аппараты такого рода являются разновидностями манометра (помогает определять давление в газах и жидкостях). При этом они отличаются по конструкции, точности и сфере применения.
- Атмосферное давление измеряется с помощью манометра, именуемого барометром. Если необходимо определить разряжение (то есть давление ниже атмосферного) — применяются другая его разновидность, вакуумметр.
- Для того чтобы узнать артериальное давление у человека, в ход идет сфигмоманометр. Большинству он более известен под именем неинвазивного тонометра. Таких аппаратов существуют немало разновидностей: от ртутных механических до полностью автоматических цифровых. Их точность зависит от материалов, из которых они изготавливаются и места измерения.
- Перепады давления в окружающей среде (по-английски — pressure drop) определяются с помощью дифференциальных манометров или дифнамометров (не путать с динамометрами).
Виды давления
Рассматривая давление, формулу его нахождения и ее вариации для разных веществ, стоит узнать о разновидностях этой величины. Их пять.
Абсолютное
Так называется полное давление, под которым находится вещество или объект, без учета влияния других газообразных составляющих атмосферы.
Измеряется оно в паскалях и являет собою сумму избыточного и атмосферного давлений. Также он является разностью барометрического и вакуумметрического видов.
Вычисляется оно по формуле Р = Р2 + Р3 или Р = Р2 — Р4.
За начало отсчета для абсолютного давления в условиях планеты Земля, берется давление внутри емкости, из которой удален воздух (то есть классический вакуум).
Только такой вид давления используется в большинстве термодинамических формул.
Барометрическое
Этим термином именуется давление атмосферы (гравитации) на все предметы и объекты, находящие в ней, включая непосредственно поверхность Земли. Большинству оно также известно под именем атмосферного.
Его причисляют к термодинамическим параметрам, а его величина меняется относительно места и времени измерения, а также погодных условий и нахождения над/ниже уровня моря .
Величина барометрического давления равна модулю силы атмосферы на площади единицу по нормали к ней.
В стабильной атмосфере величина данного физического явления равна весу столпа воздуха на основание с площадью, равной единице.
Норма барометрического давления — 101 325 Па (760 мм рт. ст. при 0 градусов Цельсия). При этом чем выше объект оказывается от поверхности Земли, тем более низким становится давление на него воздуха. Через каждый 8 км оно снижается на 100 Па.
Благодаря этому свойству в горах вода в чайниках закивает намного быстрее, чем дома на плите. Дело в том, что давление влияет на температуру кипения: с его снижением последняя уменьшается. И наоборот. На этом свойстве построена работа таких кухонных приборов , как скороварка и автоклав. Повышение давления внутри их способствуют формированию в посудинах более высоких температур, нежели в обычных кастрюлях на плите.
Используется для вычисления атмосферного давления формула барометрической высоты. Выглядит она таким образом, как на фото ниже.
Р – это искомая величина на высоте, Р – плотность воздуха возле поверхности, g – свободного падения ускорение, h – высота над Землей, м – молярная масса газа, т – температура системы, r – универсальная газовая постоянная 8,3144598 Дж⁄(моль х К), а е – это число Эйклера, равное 2.71828.
Часто в представленной выше формуле давления атмосферного вместо R используется К – постоянная Больцмана. Через ее произведение на число Авогадро нередко выражается универсальная газовая постоянная. Она более удобна для расчетов, когда число частиц задано в молях.
При проведении вычислений всегда стоит брать во внимание возможность изменения температуры воздуха из-за смены метеорологической ситуации или при наборе высоты над уровнем моря, а также географическую широту.
Избыточное и вакуумметрическое
Разницу между атмосферным и измеренным давлением окружающей среды называют избыточным давлением. В зависимости от результата, меняется название величины.
Если она положительная, ее называют манометрическим давлением.
Если же полученный результат со знаком минус – его именуют вакуумметрическим. Стоит помнить, что он не может быть больше барометрического.
Дифференциальное
Данная величина является разницей давлений в различных точках измерения. Как правило, ее используют для определения падения давления на каком-либо оборудовании. Особенно это актуально в нефтедобывающей промышленности.
Разобравшись с тем, что за термодинамическая величина называется давлением и с помощью каких формул ее находят, можно сделать вывод, что это явление весьма важно, а потому знания о нем никогда не будут лишними.
Осмотическое давление растворов
Осмос – самопроизвольный переход растворителя из раствора меньшей концентрации в раствор большей концентрации через полупроницаемую мембрану.
Проникновение растворителя в раствор и разбавление раствора можно предотвратить, если к нему приложить дополнительное давление.
Давление, которое необходимо приложить к раствору для предотвращения осмоса и приведения системы в равновесие, называется осмотическим давлением.
Осмотическое давление π (Па) рассчитывают по формуле:
для разбавленных растворов неэлектролитов,
для разбавленных растворов электролитов,
где с – концентрация растворенного вещества, моль/м 3 ; R – универсальная газовая постоянная,
R = 8,314 Дж/(моль×К); Т – температура, К.
При подстановке в формулу молярной концентрации (в моль/дм 3 ) осмотическое давление имеет размерность – кПа.
Концентрация с(моль/дм 3 ) связана с массовой долей w (%) растворенного вещества соотношением:
Пример 5. Осмотическое давление крови человека составляет 790 кПа. Массовая доля хлорида натрия в растворе, имеющем такое же осмотическое давление при a=1, равна _____ %.
Варианты ответов: 1) 0,9; 2) 0,1; 3) 0,2; 4) 9.
NaCl – электролит, дающий при диссоциации 2 иона; изотонический коэффициент равен: i = 1+1×(2-1) =2.
Концентрация NaCl в растворе составит:
.
(310 К – температура тела человека);
93.79.221.197 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Парциальное давление и объем
Когда мы имеем дело со смесями газов, важно знать, что они имеют такие характеристики, как парциальный объем и парциальное давление. Для начала определим, что такое смесь идеальных газов.
Смесь идеальных газов – это смесь нескольких газообразных веществ, которые при заданных условиях не будут вступать в определенные химические реакции.
При смене условий (например, повышении температуры, понижении давления) газовая смесь все же может вступать во взаимодействие. Важный параметр любой такой смеси – так называемая весовая концентрация g i i -ного газа-компонента.
- N – количество газов, из которых состоит смесь;
- x i i -го газа – молярная концентрация указанного газа в составе смеси;
- ν i – количество молей i -го газа, присутствующего в смеси.
Понятие парциального давления
Парциальное давление – это особая характеристика, описывающая состояние компонентов смеси идеальных газов. Сформулируем основное определение:
Парциальным называется давление p i , которое могло бы создаваться i -ым газом в смеси при условии отсутствия остальных газов и сохранения исходного объема и температуры.
Формула парциального давления будет выглядеть так:
p i = m i μ i R T V = μ i R T V
Объем смеси здесь обозначен буквой V , ее температура – T .
Следует подчеркнуть, что поскольку средние кинетические энергии молекул смеси равны, то существует и равенство температур всех компонентов газовой смеси, находящейся в состоянии термодинамического равновесия.
Для нахождения давления смеси идеальных газов нужно воспользоваться законом Дальтона в следующей формулировке:
p = ∑ i = 1 N p i = R T V ∑ i = 1 N ν i
Исходя из него, мы можем выразить парциальное давление так:
Понятие парциального объема
У газовой смеси также есть такая характеристика, как парциальный объем.
Парциальный объем V i i -газа в газовой смеси – это такой объем, который мог бы иметь газ при условии отсутствия всех остальных газов и сохранении исходной температуры и объема.
Если речь идет о смеси идеальных газов, то к ней применим закон Амага:
В самом деле, при выражении ν i из формулы выше у нас получится следующее:
ν i = p V i R T ; p = R T V p R T ∑ i = 1 N V i → V = ∑ i = 1 N V i
Для расчета парциального объема газа используется следующая формула:
Нам известно, что параметры, определяющие состояние смеси идеальных газов, будут подчиняться уравнению Менделеева-Клайперона. Формула будет выглядеть так:
p V = m μ s m R T .
Все параметры данного уравнения будут относиться ко всей смеси. Это же уравнение удобнее записать так:
Здесь параметры R s m = R μ s m = R ∑ i = 1 N q i μ i означают удельную газовую постоянную смеси.
Условие: имеется сосуд объемом 1 м 3 , в котором находится 0 , 10 · 10 — 3 к г гелия и 0 , 5 · 10 — 3 к г водорода. Постоянная температура равна 290 К . Вычислите давление смеси и парциальное давление гелия в нем.
Начнем с вычисления количества молей каждого компонента смеси. Для этого можно использовать формулу:
Зная, что молярная масса водорода, согласно таблице Менделеева, составляет μ H 2 = 2 · 10 — 3 к г м о л ь , мы можем найти количество его молей в смеси по формуле:
ν H 2 = m H 2 μ H 2
Считаем, что получится:
ν H 2 = 0 , 5 · 10 — 3 2 · 10 — 3 = 0 , 25 ( м о л ь ) .
Точно такие же расчеты проводим и для гелия, зная, что μ H e = 4 · 10 — 3 к г м о л ь :
Теперь с помощью уравнения Менделеева-Клайперона можно найти парциальное давление каждого компонента:
Сначала рассчитаем давление водорода:
p H 2 V = ν H 2 R T → p H 2 = ν H 2 R T V
Парциальное давление будет равно:
p H 2 = 0 , 25 · 8 , 31 · 290 1 = 602 , 5 ( П а ) .
Теперь то же самое подсчитываем для гелия:
p H e = 0 , 025 · 8 , 31 · 290 1 = 60 , 25 ( П а ) .
Чтобы найти общее давление смеси газов, сложим сумму давлений ее составляющих:
p = p H 2 + p H e
Подставляем полученные ранее значения и находим нужный результат:
p = 602 , 5 + 60 , 25 = 662 , 75 ( П а ) .
Ответ: общее давление смеси составляет 662 , 75 П а , а парциальное давление гелия в смеси равно 60 , 25 П а .
Условие: дана смесь газов, состоящая из 1 к г углекислого газа и 0 , 5 к г O 2 . Если считать их идеальными, какой объем они будут занимать при давлении в 1 а т м ? Температура смеси равна 300 К .
Начнем с вычисления общей массы газовой смеси.
m = m O 2 + m C O 2
Значит, m = 1 + 0 , 5 = 1 , 5 .
Переходим к вычислению массовых компонентов смеси:
g O 2 = 0 , 5 1 , 5 = 0 , 33 ; g C O 2 = 1 1 , 5 = 0 , 67 .
Тогда газовая постоянная смеси будет равна:
R s m = R ∑ i = 1 N g i μ i
R s m = 8 , 31 0 , 33 32 · 10 — 3 + 0 , 67 46 · 10 — 3 = 200 Д ж к г К .
Объем смеси вычисляем с помощью уравнения Менделеева-Клайперона:
V s m = m s m R s m T s m p s m
Вспомнив, что по условию давление равно 1 а т м , что равно 10 5 П а , вычислим объем:
V s m = 1 , 5 · 200 · 300 10 5 = 0 , 9 м 3 .
Ответ: при указанных условиях смесь займет объем, равный 0 , 9 м 3 .