Газ оказывает давление
Давление газа на стенки сосуда. Закон Дальтона
Давление газа на стенки сосуда
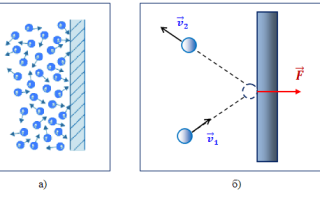
Вследствие теплового движения частицы газа время от времени ударяются о стенки сосуда (рис.1,а). При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг другом, силы ударов отдельных частиц, образуют некоторую силу давления, постоянно действующую на стенку сосуда. Молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда (рис.1,б).
Рис.1. Давление газа на стенку сосуда: а) возникновение давления вследствие ударов о стенку хаотически движущихся частиц; б) сила давления как результат упругого удара частиц.
На практике чаще всего имеют дело не с чистым газом, а со смесью газов. Например, атмосферный воздух представляет собой смесь азота, кислорода, углекислого газа, водорода и других газов. Каждый из газов, входящих в состав смеси, вносит свой вклад в суммарное давление, которое оказывает смесь газов на стенки сосуда.
Закон Дальтона для газовой смеси
Для газовой смеси справедлив закон Дальтона:
давление газовой смеси равно сумме парциальных давлений каждого компонента смеси:
Рис.2. Закон Дальтона для газовой смеси
С точки зрения молекулярно-кинетической теории закон Дальтона выполняется потому, что взаимодействие между молекулами идеального газа пренебрежимо мало. Поэтому каждый газ оказывает на стенку сосуда давление, как если бы остальных газов в сосуде не было.
Школьная Энциклопедия
Nav view search
Login Form
Давление газа
Подробности Категория: О давлении Опубликовано 02.12.2014 16:18 Просмотров: 10551
Где бы ни находился газ: в воздушном шаре, автомобильной шине, или металлическом баллоне — он заполняет собой весь объём сосуда, в котором находится.
Давление газа возникает совсем по другой причине, нежели давление твёрдого тела. Оно образуется в результате ударов молекул о стенки сосуда.
Давление газа на стенки сосуда
Двигаясь хаотично в пространстве, молекулы газа сталкиваются между собой и со стенками сосуда, в котором находятся. Сила удара одной молекулы мала. Но так как молекул очень много, и сталкиваются они с большой частотой, то, действуя сообща на стенки сосуда, они создают значительное давление. Если в газ помещено твёрдое тело, то оно также подвергается ударам молекул газа.
Проведём несложный опыт. Под колокол воздушного насоса поместим завязанный воздушный шарик, не полностью наполненный воздухом. Так как воздуха в нём мало, шарик имеет неправильную форму. Когда же мы начнём откачивать воздух из-под колокола, шарик станет раздуваться. Через некоторое время он примет форму правильного шара.
Что же произошло с нашим шариком? Ведь он был завязан, следовательно, количество воздуха в нём осталось прежним.
Всё объясняется довольно просто. Во время движения молекулы газа сталкиваются с оболочкой шарика снаружи и внутри него. Если воздух откачивается из колокола, молекул становится меньше. Уменьшается плотность, а значит и частота ударов молекул о наружную оболочку также уменьшается. Следовательно, давление снаружи оболочки падает. А так как внутри оболочки число молекул осталось прежним, то внутреннее давление превышает наружное. Газ давит изнутри на оболочку. И по этой причине она постепенно раздувается и принимает форму шара.
Закон Паскаля для газов
Молекулы газа очень подвижны. Благодаря этому давление они передают не только в направлении действия силы, вызывающей это давление, но и равномерно по всем направлениям. Закон о передаче давления сформулировал французский учёный Блез Паскаль: «Давление, производимое на газ или жидкость, передаётся без изменений в любую точку по всем направлениям». Этот закон называют основным законом гидростатики — науки о жидкости и газе в состоянии равновесия.
Закон Паскаля подтверждается опытом с прибором, который называют шаром Паскаля. Этот прибор представляет собой шар из твёрдого вещества с проделанными в нём крошечными отверстиями, соединённый с цилиндром, по которому двигается поршень. Шар заполняется дымом. При сжатии поршнем дым выталкивается из отверстий шара одинаковыми струйками.
Давление газа вычисляют по формуле:
где еlin — средняя кинетическая энергия поступательного движения молекул газа;
n — концентрация молекул
Парциальное давление. Закон Дальтона
На практике чаще всего нам приходится встречаться не с чистыми газами, а с их смесями. Мы дышим воздухом, являющимся смесью газов. Выхлопные газы автомобилей — тоже смесь. При сварке уже давно не применяется чистый углекислый газ. Вместо него также используют газовые смеси.
Газовой смесью называют смесь газов, не вступающих в химические реакции между собой.
Давление отдельного компонента газовой смеси называется парциальным давлением.
Если предположить, что все газы смеси являются идеальными газами, то давление смеси определяется законом Дальтона: «Давление смеси идеальных газов, не взаимодействующих химически, равно сумме парциальных давлений».
Его величина определяется по формуле:
Каждый газ в смеси создаёт парциальное давление. Его температура равна температуре смеси.
Давление газа можно изменить, меняя его плотность. Чем больше газа будет закачано в металлический баллон, тем больше в нём будет молекул, ударяющихся о стенки, и тем выше станет его давление. Соответственно, откачивая газ, мы разрежаем его, и давление снижается.
Но давление газа также можно изменить, изменив его объём или температуру, то есть, сжав газ. Сжатие проводят, воздействуя силой на газообразное тело. В результате такого воздействия уменьшается занимаемый им объём, повышается давление и температура.
Газ сжимается в цилиндре двигателя при движении поршня. На производстве высокое давление газа создают, сжимая его с помощью сложных устройств — компрессоров, которые способны создать давление до нескольких тысяч атмосфер.
Причина давления газа
Газ:
· Молекулы находятся относительно далеко друг от друга,
· Молекулы постоянно двигаются и могут оказаться в любой части пространства,
· Газ не имеет своей формы и объема,
· Газ занимает весь предоставленный объем.
Давление газа на стенки сосуда (и помещенное в газ тело) вызывается ударами молекул газа.
Опыты:У вас в учебнике приведены опыты. На первом мы наблюдаем, как по мере откачивания воздуха из колокола воздушного насоса, полунадутый шарик начинает раздуваться (рис. 91 учебника). Такое поведение шарика можно объяснить лишь тем, что число ударов молекул воздуха о внешнюю поверхность шарика уменьшается, и объем шарика растет до той величины, при которой сила давления воздуха внутри шара не сравняется с силой упругости оболочки.
Так как форма шарика близка к сферической, можем заключить, что давление газа по всем направлениям одинаково.
Газ давит на сосуд, в котором находится по всем направлениям одинаково.
Зависимость давления газа от объема
Опыт, в котором в стеклянном сосуде находится воздух, с одной стороны сосуд закрыт резиновой пленкой – мембраной, а с другой поршнем. Если поршень вдавливать в сосуд, то мембрана раздувается, то есть на нее действует большее давление. И наоборот, если поршень выдвигать, то мембрана прогибается внутрь, значит давление газ на нее оказывает меньше.
Легко заметить, что уменьшение объема газа приводит к увеличению его давления. Это связано с тем, что плотность газа возрастает, число ударов молекул о мембрану также становится больше. Это приводит к росту давления.
При уменьшении объема газа его давление увеличивается, а при увеличении объема давление уменьшается при условии, что масса и температура газа остаются неизменными.
На этом же принципе работают пипетки, резиновая груша. (Учитель показывает работу пипетки, резиновой груши, шприца)
Зависимость давления газа от температуры
Известно, что скорость движения молекул газа при нагревании увеличивается. Двигаясь быстрее, молекулы ударяются о стенки сосуда чаще. Кроме того, каждый удар молекулы о стенку сосуда становится сильнее. Вследствие этого стенки сосуда испытывают большее давление.
Это можно наблюдать, если воздушный шарик с морозного воздуха занести в теплую комнату: очень скоро объем шарика увеличится, т.к. возрастет давление газа внутри него.
Давление газа в закрытом сосуде тем больше, чем выше температура газа.
Из сказанного нами выше можно сделать общий вывод о том от чего же зависит давление газа.
93.79.221.197 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Давление в жидкостях и газах
Содержание
- Давление в газах
- Давление в жидкостях
- Задачи
- Что мы узнали?
- Тест по теме
Давление в газах
Молекулы газа (как и жидкости) не связаны в жесткую структуру, а двигаются хаотично. Если ограничить жидкость или газ емкостью некоторого объема, то молекулы начнут ударятся о стенки емкости и создавать давление, определяемое формулой $P =
Очевидно, что молекулы обладают очень малой массой, поэтому сила их удара много меньше площади удара и, соответственно, давление, создаваемое одной молекулой также будет малым. Но вспомним, что при стандартных условиях в одном моле вещества содержится 6⋅10 23 молекул. В сумме все молекулы создают ощутимое давление.
Рис. 1. Хаотическое движение молекул газа.
Теперь увеличим количество молекул, но объем оставим неизменным. Ударов о стенки станет больше, давление возрастет. Также давление будет увеличиваться, если скорость хаотического движения молекул возрастет, а скорость, как известно, зависит от температуры газа: $v =
Эти закономерности отражены в формуле для давления газа, выводимой в рамках молекулярно-кинетической теории: $p = nkT$, где n – концентрация, k – постоянная Больцмана и T – температура.
Давление в жидкостях
Предыдущие рассуждения справедливы и для жидкостей. Но в них расстояние между молекулами меньше, поэтому при одинаковом объеме жидкость будет иметь большую массу. Рассмотрим столб воды в поле силы тяжести и разобьем его на некоторое количество малых слоев. Самый первый слой будет давить на все нижележащие с силой $F = rho gV$.
Рис. 2. Давление столба жидкости.
Давление, зависящее от высоты столба жидкости, называют гидростатическим. Оно определяется формулой:
$p = rho gh$, где h – высота столба. Она получается в результате деления выражения для F на площадь слоя.
В газах также существует гидростатическое давление. Например, на поверхность земли давит толща атмосферы.
Полное давление в жидкостях и газах будет складываться из давления, оказываемого сторонней силой и гидростатического. В земных условиях для жидкостей внешним давлением чаще всего выступает атмосферное. Для газов же необходимо добавить давление, создаваемое хаотическим движением молекул.
Важным является закон для жидкостей и газов, который устанавливает, что внешнее давление распространяется по всему объему вещества без изменения. Его называют законом Паскаля. Благодаря нему справедливо предыдущее утверждение о полном давлении.
Рис. 3. Закон Паскаля.
- Скорость молекул в идеальном газе υ, масса одной молекулы газа – m, объем всего газа – V. Определить давление газа, если его плотность – $rho$.
Решение
Учитывая, что концентрация $n =
Открытый сосуд высотой 2 м на четверть заполнили водой. Определить полное давление на дно сосуда.
Запишем формулу полного давления:
$P = P_0 + rho gh$. Так как сосуд открытый, на него действует атмосферное давление.
Поэтому полное давление будет равно:
Что мы узнали?
В ходе урока было рассмотрено, как возникает давление в жидкостях и газах, были введены понятия гидростатического давления, внешнего давления и давления хаотического движения молекул, а также рассмотрены формулы для их расчета. В завершении урока были решены две задачи на пройденные темы.
Давление газа
Урок 22. Физика 7 класс
Конспект урока «Давление газа»
это самое давление»
В этой теме речь пойдёт о том, каким образом могут оказывать давление газы.
В газах молекулы расположены друг от друга на большом расстоянии, поэтому, силы взаимного притяжения между молекулами практически отсутствуют. Известно также, что газы легко сжимаются. Молекулы газа двигаются беспорядочно, занимая весь предоставленный им объём. Молекулы сталкиваются не только друг с другом, но и ударяются о стенки сосуда. Именно эти удары и создают давление. Сила удара одной молекулы ничтожно мала, но ведь количество молекул даже в маленьком сосуде очень велико.
Рассмотрим классический опыт: возьмем завязанный шарик с небольшим количеством воздуха и накроем его стеклянным сосудом. Если выкачать из сосуда воздух, то объём воздушного шарика увеличится. Почему же это произошло? Дело в том, что изначально по шарику ударяли молекулы воздуха внутри сосуда, противодействуя ударам молекул внутри шарика. Таким образом, оболочка шарика сохраняла свой объём. Но когда воздух был откачен из сосуда, во много раз уменьшилось количество молекул воздуха внутри него. Ударов по шарику снаружи стало гораздо меньше, но вот количество молекул внутри шарика не изменилось. Это позволило газу внутри шарика расширяться до тех пор, пока давление газа внутри не стало равно давлению газа снаружи. Из этого можно сделать вывод, что при увеличении объёма, давление газа уменьшается. Но если мы вновь наполним сосуд воздухом, то шарик снова сдуется. Значит, при уменьшении объёма, давление увеличивается.
Следует понимать, что эти утверждения верны только в том случае, если речь идет о неизменной массе газа, находящейся при неизменной температуре. Также следует отметить: когда воздух был откачен из сосуда, форма шарика действительно стала шарообразной (а не вытянутой, как это было изначально). Это значит, что газ давит на оболочку шарика (или стенки сосуда) одинаково по всем направлениям. Это объясняется беспорядочным движением молекул. Они двигаются в случайных направлениях, но их число настолько велико, что можно с уверенностью сказать, что во всех направлениях летит одинаковое число молекул. В результате этого на каждый маленький кусочек площади поверхности шарика приходится одинаковое число ударов, то есть, создается одинаковое давление.
Проведем еще один опыт: возьмем цилиндр с подвижным поршнем и поместим туда некоторое количество газа.
Если поршень будет двигаться, то можно изменять объём газа, при этом сохраняя его массу. Таким образом, плотность газа увеличиться, то есть на единицу объёма будет приходиться большее число молекул газа. В этом случае, они значительно чаще будут ударяться о стенки сосуда. То есть, таким способом можно увеличить давление. Это еще раз доказывает, что при уменьшении объёма газа постоянной массы и температуры, давление увеличивается, а при увеличении объёма – давление уменьшается.
Если плотно закрыть пластиковую бутылку и сжать её, то можно почувствовать значительное сопротивление – молекулы газа будут давить на стенки бутылки изнутри, не давая вам сжать её.
Поставим опыт: Не будем изменять ни массу газа, ни его объём, а просто нагреем газ в плотно закрытом сосуде. В этом случае давление газа увеличится. Это объясняется тем, что при увеличении температуры, молекулы газа начинают двигаться быстрее, а, следовательно, будут чаще ударяться о стенки сосуда. То есть, при увеличении температуры газа постоянной массы и объёма, давление газа увеличивается, и, наоборот, при уменьшении температуры, давление газа уменьшается. Если слегка заткнуть стеклянную бутылку пробкой и нагреть бутылку, то пробка выскочит из горлышка под давлением газа.
Зависимость давления газа от температуры нередко используется людьми. Например, чтобы поместить большое количество газа в сравнительно небольшой объём, газ охлаждают и закачивают в баллон. После того, как газ вновь нагревается, в баллоне создается очень высокое давление. Именно поэтому на таких баллонах, как правило, пишут предупреждения о том, чтобы баллон ни в коем случае не нагревали и не ударяли (это может привести к взрыву – настолько в баллоне высокое давление).
Примеров давления газа можно привести очень много: это и накачанный мяч, и накачанные шины автомобиля, и атмосферное давление.
Упражнение 1. Из баллона медленно выпустили половину газа и снова закрыли его. Как изменится давление в баллоне?
Поскольку молекул газа внутри баллона стало вдвое меньше, они вдвое меньше стали ударяться о стенки баллона. Следовательно, давление уменьшилось вдвое.
Упражнение 2. Одинаковые массы одного и того же газа находятся в двух баллонах: зеленом и синем. Известно, что температура и в том, и в другом баллоне одинакова. В каком баллоне давление будет больше?
По условию задачи, в обоих баллонах одинаковые условия. Из рисунка явно видно, что синий баллон больше зеленого. Поэтому давление в нем будет меньше, поскольку молекулы газа меньше будут ударяться о его стенки.
Упражнение 3. Воздушный шарик завязали и облили его ледяной водой. Из-за этого шарик немного сжался. Можете ли вы объяснить, почему это произошло?
Из-за понижения температуры, давление внутри шарика уменьшилось. В результате внешнее давление сжимало шарик до тех пор, пока внутреннее давление вновь ни стало равным внешнему.
– Давление газа – это давление, которое создается в результате ударов молекул о стенки сосуда (или о какое-то другое тело).
– Давление газа одинаково по всем направлениям.
– При неизменной массе и температуре, давление газа тем больше, чем меньше его объём. И, наоборот, давление газа тем меньше, чем больше объём.
– При постоянной массе и объёме, давление можно изменить, изменяя температуру. При нагревании газа, его давление будет увеличиваться, а при охлаждении – наоборот, уменьшаться.