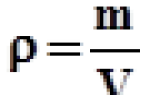Влияние давления на электропроводность
Справочник химика 21
Химия и химическая технология
Влияние давления на электропроводность
В заключение данного раздела рассмотрим материалы об изменении проводимости с изменением давления и температуры и связь этого свойства с вязкостью. Влияние давления на электропроводность объяснялось происходящим при этом изменением константы диссоциации и объема раствора. В дальнейшем стали также учитывать изменение вязкости [37, стр. 649—651]. [c.9]
Влияние концентрации, температуры и давления на электропроводность раствороп электролитов [c.112]
Следовательно, с ростом давления электропроводность должна уменьшаться, если фактор увеличения вязкости оказывает большее влияние, чем изменение степени диссоциации. [c.182]
Примером значительного влияния давления на равновесие в жидкой фазе является смещение ионного равновесия и связанное с ним изменение электропроводности растворов при высоких давлениях. Чтобы судить о влиянии давления на ионное равновесие, необходимы данные о парциальных ионных объемах (на моль диссоциированного электролита). Однако определить абсолютную величину парциальных ионных объемов в настоящее время не представляется возможным. Если же принять, например, величину в водном растворе при 25 и 1 атм равной нулю, то можно вычислить относительные парциальные объемы других ионов в тех же условиях по величинам парциальных мольных объемов электролитов в бесконечно разбавленных водных растворах. Так, по значению парциального мольного объема полностью диссоциированной соляной кислоты можно найти г с1- (считая ун+= 0), затем, проведя такое же измерение с раствором хлористого натрия, найти [c.53]
В случае сильных электролитов возможна приближенная оценка влияния давления на константу диссоциации их в неводных растворителях. Данные об электропроводности растворов KJ в этиловом спирте и ацетоне при 20° и давлениях до 2500 атм [841 также позволяют сделать качественный вывод об увеличении степени диссоциации с повышением давления. [c.56]
Этот метод использовали при исследовании некоторых ионных реакций в воде с подходящими значениями А7, когда за реакцией можно было удобно следить по изменению электропроводности. Лучше всего проводить сравнение влияния давления на электропроводность в двух ячейках, одна из которых содержит реакционную смесь, а другая — раствор нереагирующего электролита в том же растворителе это необходимо из-за того, что при изменении давления электропроводность меняется как вследствие изменений объема и вязкости, так и в результате реакции, причем последний эффект может быть относительно мал. [c.79]
С повышением давления электропроводность электролита увеличивается. Однако влияние давления на электропроводность незначительно и практически сказывается только при применении весьма высоких давлений (свыше 100 атм). [c.243]
ВЛИЯНИЕ ДАВЛЕНИЯ НА ЭЛЕКТРОПРОВОДНОСТЬ [c.397]
Изучение изменений электропроводности под действием давления способствует пониманию механизма ионной миграции. Однако вследствие слабой сжимаемости жидкостей эксперименты необходимо проводить при весьма высоких давлениях. С развитием техники высоких давлений появилась возможность выполнить такие эксперименты. Известные же данные недостаточны для разработки общей теории влияния давления на проводимость растворов электролитов. [c.404]
Другим обстоятельством, которое указывает на наличие зависимости между подвижностью ионов и вязкостью, является влияние давления на электропроводность электролитов. Для бесконечных разбавлений данные отсутствуют, поэтому на рис. 23 приведены результаты опытов для ряда электролитов в 0,01 н. водных растворах при 20°. По оси ординат отложены отношения эквивалентной электропроводности при давлении р к соответствующей величине при давлении р = , т. е. Ар Ах, а по оси абсцисс — давления [20]. Пунктирная кривая показывает, как меняется в зависимости от давления отношение текучести (т. е. величины, обратной вязкости) воды при давлении р к текучести при р—. Наличие максимумов как на кривых электропроводности, так и на кривой текучести свидетельствует о наличии известного параллелизма между этими величинами точного соответствия этих величин можно [c.102]
Влияние давления. По тем же причинам, которые объясняют влияние температуры на электропроводность, можно также предвидеть и влияние давления. С возрастанием давления может быть вызвано изменение концентрации, трения и диссоциации. Оставляя в стороне первое, которое мы можем элиминировать вычислением, и применяя сильно диссоциированные растворы солей, у которых не приходится опасаться сколько-нибудь значительного изменения диссоциации (с возрастанием давления степень диссоциации может лишь увеличиваться, так как диссоциация электролита, насколько известно, во всех растворителях связана с уменьшением объема), можно было бы ожидать тесной связи между изменением электропроводности и внутренним трением воды, которое уменьшается в исследованной области давлений (до 500 атмосфер) и температур (от О до 23°). Это и принималось на основании имеющихся до сих лор измерений. [c.113]
Своеобразно влияние давления на тангенс угла диэлектрических потерь, обусловленных электропроводностью материала. В случае ионной проводимости электропроводность и, соответственно, tg б уменьшаются при увеличении давления, в случае электронной проводимости увеличение давления приводит к росту электропроводности и tg б [212]. [c.136]
ЦИИ. Подобный же вывод может быть сделан на основе данных Эллиса [143] но электропроводности при высоких давлениях. Оценка влияния давления на аномальную подвижность Н+ (отнесенную к подвижности и с учетом зависимости плотности и концентрации от давления) дает значение объема активации между —2,4 и —2,9 см -моль . Поскольку зависимость частотной дисперсии диэлектрической постоянной воды от давления не измерена, величина А]/ для процесса диэлектрической релаксации неизвестна. Можно предполагать, что в чистой жидкости объем активации будет полол » вполне допустимо и соответствует увеличению электрострикции несвязанных молекул воды при образовании связи между ними и ионом НзО . Этот процесс будет сопровождаться отрицательным изменением объема. Непосредственная близость, атома кислорода может облегчить процесс переноса. [c.136]
Примером значительного влияния давления на равновесие в жидкой фазе является смещение ионного равновесия и связанное с ним изменение электропроводности растворов при высоких давлениях. Чтобы судить о влиянии давления на ионное равновесие, необходимы данные о парциальных ионных объемах (на моль диссоциированного электролита). Однако определить абсолютную величину парциальных ионных объемов в настоящее время не представляется возможным. Если же принять, например, величину v + в водном растворе при 25° С и 1 атм равной нулю, [c.59]
В последние годы были выполнены интересные исследования влияния давления на ионное равновесие в растворах слабых электролитов. Авторы определяли электропроводность этих растворов при различных концентрациях и давлениях и вычисляли по полученным данным степень диссоциации и константу ионного равновесия (диссоциации), которую затем экстраполировали к нулевой концентрации для нахождения ее истинного значения (Кт)- Зависимость К,п от давления в разбавленных растворах определяется, как и для [см. уравнение (1.60), изменением парциального мольного объема электролита при его диссоциации (АОо)- [c.64]
Увеличение проводимости диффузии с увеличением давления Ог будет, естественно, иметь свой предел. Как только наступит насыщение внешних слоев пленки кислородом, дальнейшее увеличение давления кислорода уже не будет оказывать влияния на электропроводность или скорость диффузии в окисле. [c.57]
Исследовалось влияние добавок фторидов натрия, лития, рубидия, цезия к бифториду калия на физико-химические свойства последнего. Оказалось, что добавки ЫаР, Ь1Р, КЬР, СзР мало влияют на температуру плавления, плотность и электропроводность электролита и на уменьшение давления паров НР над ним. А так как всякое усложнение состава электролита вызывает дополнительные усложнения в контроле его и поддержании состава при электролизе, то существенных технико-экономических преимуществ подобные добавки к электролиту не дают. [c.332]
Другой метод заключается в добавке соли к манометрической жидкости для придания ей электропроводности. Сила тока при напряжении 6—8 в составляет около 10 в уси.яения до 10—15 а (ири 220 в) достигают посредством включения в схему промежуточного электронного реле (см. главу 8.22). Для регулирования давления в сосуде, который термостатируют для исключения влияния изменений температуры, создают заданное давление (рис. 402). При равенстве давлений в термостатированном сосуде и в установке уровень манометрической жидкости в обоих коленах одинаков. При повышении давления в установке уровень жидкости в правом колене понижается. Контакт в левом колене в результате повышения уровня жидкости замыкается, и через электронное реле включается вакуум-насос, который откачивает систему до выравнивания давлений. При помощи автоматизированного стенда (рис. 399) во время испытаний с чистыми веществами в интервале давлений 300—1 мм рт. ст. была достигнута точность регулировки + 0,1 мм рт. ст. Для фенола это соответствует при 20 мм рт. ст. разнице температур кинения 0,1°. Если, например, при разделении изомеров ксилола при 70 мм рт. ст. необходимо измерять температуру с воспроизводимой точностью 0,1°, то для этого требуется регулировать давление с точностью не ниже 0,15 мм рт. ст. [40]. [c.499]
С увеличением температуры электропроводность растет. При анализе причин этого явления необходимо рассмотреть два фактора а) уменьщение вязкости среды, т. е. уменьщение сопротивления движения ионов, б) возможное уменьшение степени диссоциации в случае экзотермических процессов. Однако фактор изменения степени диссоциации оказывает меньшее влияние, чем уменьшение вязкости, поэтому и наблюдается рост электропровод-нрсти при увеличении температуры. Влияние давления однозначно охарактеризовать нельзя, но в целом его действие противоположно действию температуры при его росте вязкость увеличивается. [c.181]
Зависимость чисел переноса от давления, как и влияние температуры, определяется относительным воздействием давления на подвижности обоих ионов. Предварительный анализ ранних данных по электропроводности, выполненный Кеем и Эвансом [12], создал впечатление, что описанные выше эффекты, связанные с сольватными оболочками, способны объяснить коэффициенты по давлению. Последующие точные измерения чисел переноса [26] при давлениях до 3 кбар показали, что влияние давления на сольватные оболочки [c.81]
В этой статье описывается установка, которая применялась для измерения электропроводности порошковых углеродйстых материалов, Существует стандартная методика измерения электропроводности порошков коксов при комнатной температуре 2]. Но эта методика, на наш взгляд, имеет два существенных недостатка во-первых, применение метода амперметра и вольтметра вносит погрешность за счет сопротивления контактов и, во-вторых, всегда требуется брать точную навеску порошка и с высокой точностью определять высоту насыпки. Для получения температурной зависимости такая методика становится совершенно непригодной. Порошок под влиянием давления и температуры уплотняется, и высота насыпки непрерывно уменьшается. [c.116]
Мильнер (Milner, 1913) впервые показал, что ионы в растворе электролита не распределены совершенно хаотично (в последнем случае электростатические силы притяжения и отталкивания, оказываемые ими один на другой, должны были бы взаимно уравновешиваться), но что в среднем вследствие электростатического притяжения в соседстве с каждым положительным ионом находится больше отрицательных, чем лоложительных ионов, и, наоборот, вокруг каждого отрицательного иона находится больше положительных ионов, чем отрицательных. Это обстоятельство, однако, независимо от его влияния на электропроводность раствора создает условия, при которых ионы удерживаются в растворе прочнее, чем незаряженные молекулы. Вследствие этого лри вычислении значения осмотического давления нельзя приравнивать ионы к незаряженным молекулам. [c.91]
Измерив на опыте эквивалентную электропроводность исследуемого раствора X, нетрудно определить степень диссоциации Смотреть страницы где упоминается термин Влияние давления на электропроводность: [c.54] [c.152] [c.45] [c.5] [c.5] [c.206] [c.63] [c.12] [c.121] [c.177] [c.445] Смотреть главы в:
Электропроводность электролитов (стр. 1 из 6)
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Белгородская государственная технологическая академия строительных материалов
Кафедра физической и коллоидной химии
Выполнил: ст. гр. ПЭ-31
Проверил: Лопанов А.Н.
1. Электропроводность электролитов…………………………………..4
1.1. Удельная и молярная электропроводности…….…….…..……..4
1.2. Эквивалентная электропроводность…………………………….7
2.1. Зависимость подвижности ионов от температуры…………. 11
2.2. Зависимость подвижности ионов от
3. Аномальная подвижность ионов гидроксония
5. Закон разбавления Оствальда………………………………………..19
6. Электрофоретический и релаксационный эффекты
в электролитах, их влияние на электрическую проводимость……22
7. Методы измерения электропроводности электролитов………..….25
Список используемой литературы…………………………………28
Электролиты (от электро и греч. lytos — разлагаемый, растворимый), жидкие или твёрдые вещества и системы, в которых присутствуют в сколько-нибудь заметной концентрации ионы, обусловливающие прохождение электрического тока. В узком смысле электролиты называются вещества, растворы которых проводят электрический ток ионами, образующимися в результате электролитической диссоциации. Электролиты в растворах подразделяют на сильные и слабые. Сильные электролиты практически полностью диссоциированы на ионы в разбавленных растворах. К ним относятся многие неорганические соли и некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.). Молекулы слабых электролитов в растворах лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах. Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др.
По количеству ионов, на которые диссоциирует в растворе одна молекула, различают бинарные, или одно-одновалентные электролиты (обозначаются 1-1 электролит, например КС1), одно-двухвалентные электролиты (обозначаются 1-2 электролит, например CaCl2 ) и т. д. Электролиты типа 1-1, 2-2, 3-3 и т. п. называются симметричными, типа 1-2, 1-3 и т. п. — несимметричными.
Свойства разбавленных растворов слабых электролитов удовлетворительно описываются классической теорией электролитической диссоциации. Для не слишком разбавленных растворов слабых электролитов, а также для растворов сильных электролитов эта теория неприменима, поскольку они являются сложными системами, состоящими из ионов, недиссоциированных молекул или ионных пар, а также более крупных агрегатов. Свойства таких растворов определяются характером взаимодействий ион-ион, ион-растворитель, а также изменением свойств и структуры растворителя под влиянием растворённых частиц. Современные статистические теории сильных электролитов удовлетворительно описывают свойства лишь очень разбавленных ( 2 . Из уравнения (2) имеем:
Полученное выражение показывает, что размерность, т. е. единица удельного сопротивления, выражается величиной [ρ]=0м м.
Единица удельной электрической проводимости, т. е. размерность ее, выражается обратной величиной x=1/(0м м) = Oм -l •м -l = Cм м -1 .
Повышение температуры на 1 К увеличивает удельную электрическую проводимость примерно на 2 — 2,5%. Это объясняется понижением вязкости раствора и уменьшением гидратации ионов, а для растворов слабых электролитов увеличением их степени диссоциации.
Зависимость удельной электрической проводимости разбавленных растворов от температуры описывается эмпирическим уравнением
xT = x298 [1 + α (T — 298) +β (Т- 298) 2 ];
β = 0,0163 (α — 0,0174),
где x298 – удельная электрическая проводимость при 298 К; α и β — температурные коэффициенты электрической проводимости. Коэффициенты α и β зависят от природы электролита: для сильных кислот α = 0,0164, для сильных оснований α = 0,0190, для солей α = 0,0220.
В растворах слабых электролитов диссоциация молекул электролита на ионы увеличивает объем раствора. Поэтому повышение давления в соответствии с принципом смещения подвижного равновесия Ле Шателье – Брауна уменьшает степень диссоциации электролита и, следовательно, электрическую проводимость. Заметное влияние на электрическую проводимость раствора слабого электролита оказывает только давление порядка сотен и тысяч атмосфер. Например, повышение давления до 2000 атм уменьшает x для уксусной кислоты на 40%.
При изучении электрической проводимости растворов целесообразно пользоваться молярной электрической проводимостью Λ, которая равна электрической проводимости объема раствора электролита, содержащего 1 г/моль растворенного вещества и находящегося между двумя параллельными электродами, расположенными на расстоянии одного метра друг от друга. Для слабых электролитов изменение молярной электрической проводимости от концентрации раствора связано в основном со степенью диссоциации и для сильных электролитов — с межионным взаимодействием.
Удельная и молярная электрические проводимости связаны между собой соотношением:
где Vм — число кубометров раствора, содержащего 1 г/моль электролита; См — концентрация электролита, выраженная в моль/м 3 . Для практических расчетов можно использовать также размерности в производных единицах СИ: [χ]=См см -1 ; [Λ] = См см 2 •моль -1 ; [с] = моль/л (моль/дм 3 ). При этом вместо уравнения (5) получаем:
При вычислении молярной электрической проводимости нужно указывать формульную единицу, для которой она вычислена. Так, например, при 298 К в водном растворе при предельном разбавлении A(MgCl2 )=258 · 10 4 См м 2 • моль -1 , но Λ (MgCl2 ) = 129 • 10 4 См • м 2 моль -1 .
Молярная электрическая проводимость с уменьшением концентрации раствора увеличивается и при с → 0 стремится к некоторому предельному максимальному значению Λ∞ , которое называется молярной электрической проводимостью при предельном (бесконечном) разбавлении. Например, для предельно разбавленных растворов НС1, КС1 и NH4 OH значения Λ∞ , при 298 К соответственно равны 426 · 10 4 ; 149,8 10 4 и 271,4 10 4 См м 2 моль -1 .
Зависимость молярной электрической проводимости от температуры можно представить уравнением:
где ΛТ и Λ298 — молярные электрические проводимости при температуре Т = 298 К; α — температурный коэффициент электрической проводимости. Уравнение (7) справедливо для узкого интервала температур. Логарифмируя уравнение (6), получаем:
Беря производную по температуре от уравнения (8), находим:
Из уравнения (9) следует, что температурные коэффициенты удельной и молярной электрической проводимости одинаковы.
Рассмотрим зависимость молярной электрической проводимости раствора бинарного электролита от скорости движения ионов. Пусть электрический ток проходит через раствор бинарного электролита, помещенный в стеклянную трубку с поперечным сечением s м 2 , причем расстояние между электродами равно l м и разность потенциалов между ними равна Е В. Обозначим через u ‘+ и u’— скорости движения катионов и анионов, м/с, а через см концентрацию раствора электролита, г/моль/м 3 . Если степень диссоциации электролита в данном растворе равна α, то концентрации катионов и анионов равны αсм г/моль/м 3 . Подсчитаем количество электричества, которое переносится через поперечное сечение трубки за 1 с. Катионов за это время пройдет через сечение u ‘+ sαc м г/моль и они перенесут u ‘+ sαc м F Кл электричества, так как г/моль переносит количество электричества, равное числу Фарадея F . Анионы в обратном направлении перенесут u ‘— sαc м F Кл электричества. Сила тока I, т. е. общее количество электричества, проходящее через данное поперечное сечение раствора в 1 с, равна сумме количеств электричества, переносимого ионами в обоих направлениях:
Факторы, влияющие на электропроводность растворов
Природа ионов, природа растворителя
Подвижность тем больше, чем выше заряд и чем меньше размер иона, и чем меньше вязкость среды.
Ионы гидроксония (Н3О + )и гидроксила (ОН — ) в водных растворах обладают аномально большой подвижностью за счет эстафетного механизма переноса протонов:
Н + Н +
А) При повышении температуры вязкость раствора уменьшается, а подвижность ионов увеличивается.
Б) Температура влияет на степень диссоциации. С увеличением температуры увеличивается степень диссоциации, что ведет к возрастанию концентрации ионов, но эта зависимость не однозначна.
В сильноразбавленных растворах концентрация ионов мала, и их движению ничего не препятствует. Для предельно разбавленных растворов Кольрауш сформулировал следующий закон (закон независимого движения Кольрауша): в бесконечно разбавленном растворе ионы движутся независимо друг от друга:
где к 0 и а 0 – молярные подвижности ионов при предельном разбавлении (предельные подвижности).
Это уравнение справедливо и для сильных и для слабых электролитов.
Казалось бы, молярная электропроводность рассчитывается уже с учетом концентрации и не должна от нее зависеть. Но с ростом концентрации электролита молярная электропроводность будет зависеть и от степени диссоциации (, в основном для слабых электролитов) и от электрического взаимодействия между ионами (в основном для сильных электролитов).
Для чистого раствора слабого электролита:
Это соотношение называется уравнением Аррениуса. Подставляя его в закон разведения Оствальда Кд = α 2 с / (1- α), получим:
Для раствора же сильного электролита аналогичное соотношение приобретает вид: = f ,
где f — коэффициент электрической проводимости, учитывающий межионные взаимодействия.
Графический вид зависимости молярной электропроводности от концентрации представлен на рисунке.
Эта зависимость может быть объяснена только с позиций теории электрической проводимости сильных электролитов Дебая и Онзагера, которая основана на электростатической теории сильных электролитов Дебая и Хюккеля, и объясняет уменьшение молярной электропроводности при переходе от бесконечно разбавленного раствора к растворам конечных концентраций появлением эффектов торможения движения ионов.
Релаксационный эффект торможения связан с существованием ионной атмосферы. При перемещении под действием внешнего электрического поля центральный ион выходит из центра ионной атмосферы, которая вновь воссоздается в новом положении иона. Этот процесс происходит не мгновенно, а в течение некоторого времени (времени релаксации). Поэтому заряд ионной атмосферы позади центрального иона больше, чем впереди. Возникающие при этом силы электростатического притяжения тормозят движение иона.
Электрофоретический эффект торможения. Этот эффект торможения возникает за счет того, что сольватированная ионная атмосфера, обладая зарядом, противоположным по знаку заряду центрального иона, движется в противоположном направлении. Таким образом, сольватированный центральный ион под действием электрического напряжения перемещается не в неподвижной среде, а в среде, перемещающейся ему навстречу, что приводит к снижению его скорости движения.
Зависимость удельной электрической проводимости растворов от концентрации.
Графическая зависимость удельной электропроводности от концентрации имеет вид, изображенный на рис.
Начальный рост удельной электропроводности обусловлен увеличением концентрации ионов (числа носителей заряда), а дальнейший спад связан с увеличением сил межионного взаимодействия в растворах сильных электролитов и уменьшением степени диссоциации в растворах слабых электролитов. Согласно формуле: æ = С( 0 К + 0 А)10 3 .
Электропроводность растворов находят кондуктометрическим методом, определяя сопротивление Rяч в специальной двухэлектродной ячейке с платиновыми электродами, включенной в мостовую схему переменнотоковых измерений (схему моста Уитстона). Удельную электропроводность находят по формуле:
где Кяч – постоянная данной ячейки.
Организм с точки зрения электрохимии можно рассматривать как систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов. Биологические ткани и жидкости являются проводниками второго рода, в которых электричество переносится ионами электролитов. Удельная электропроводность клеток составляет приблизительно 10 -3 –10 -9 Ом -1 м -1 , а межклеточной жидкости – 10 -3 Ом -1 м -1 . По электропроводности биологические ткани можно располагаются: кровь, лимфа, желчь > мышечная ткань, серое вещество мозга > ткани легких, печени, сердца > жировая ткань, костная ткань > слой эпидермиса кожи.
Тема: Влияние минерализации, температуры и магнитного поля на электропроводность воды
Международный конкурс научно-технических работ школьников «Старт в науку» _______________________________________________________
Тема: Влияние минерализации, температуры и магнитного поля
Автор: Бирюков Валентин, Зверьков Евгений
Место выполнения работы: Оренбургский Государственный Университет
Вода, пожалуй, самое удивительное и, несомненно, самое важное для жизни вещество на Земле. Она обладает рядом свойств, резко отличающих её от других жидкостей, и представляет собой еще не расшифрованную, чрезвычайно гибкую и изменчивую структуру, зависящую от малейших изменений давления, температуры, примесей и разнообразных энергетических полей [1-9].
Молекулы воды имеют очень простую ассиметричную структуру (см. рисунок 1), благодаря которой обладают высоким дипольным моментом. Это определяет высокую диэлектрическую проницаемость воды и способность растворять и диссоциировать многие вещества. В ней в растворенном виде могут присутствовать чуть ли не все элементы периодической таблицы Менделеева.
Рис. 1. Строение молекулы воды и водородные связи между молекулами
воды (обозначены пунктиром).
Наличие низкоэнергетических водородных связей между молекулами воды определяет её чувствительность к внешним воздействиям [3]. В связи с этим воде приписывают различные интересные, и даже удивительные свойства, приобретаемые её в результате воздействия звуковых волн (тексты, музыка, ультразвук и т. п.), электромагнитных полей, низких температур, давлений и т. д.
На протяжении многих веков эффекты энергоинформационных воздействий на воду и системы содержащие воду использовали и продолжают использовать в настоящее время, в том числе в различных оккультных, парапсихологических и магических методах, таких как лечение различных заболеваний «заряженной» водой, избавление от алкогольной зависимости, наведение порчи, приворот и т. п.
В частности, опубликовано множество статей о магнитной обработке воды и использовании «омагниченной» воды в энергетике, строительстве, сельском хозяйстве, медицине [9]. Однако до настоящего времени отсутствуют теоретически и экспериментально обоснованные модели и механизмы объясняющие кратковременные и долговременные эффекты энергоинформационных воздействий на воду.
В связи с этим представляет большой интерес выяснение реальности подобного рода явлений, их механизма и связи со структурой и свойствами воды, а также влияния на воду и водные системы электромагнитных полей и других внешних факторов, не связанных непосредственно с изменением химического состава воды и водных растворов.
Следует помнить о том, что подготовка воды к использованию (водоподготовка) – очень важная сфера народного хозяйства с много миллиардными оборотами и прибылями, в которой задействовано большое количество серьезных и ответственных фирм. При разнообразном использовании воды весьма важно иметь представление о степени её минерализации, наличии тех или иных примесей, её структурном состоянии.
Оценка качества воды перед употреблением представляет достаточно сложную и трудоёмкую проблему, которая на практике решается, как правило, лишь частично и эпизодически. Многие индивидуальные потребители воды часто не имеют ни малейшего представления о её составе, о том полезна она или вредна для организма, как улучшить её качество. Особенно это касается воды, которая поступает в наши квартиры по старым изношенным трубам.
Поэтому систематическое изучение физических параметров воды (электропроводности, диэлектрической и магнитной проницаемости, вязкости и поверхностного натяжения и т. п.) в зависимости от различного рода примесей и воздействий может развеять многие сомнительные представления об удивительных свойствах воды, а также привести к разработке системы экономичного непрерывного мониторинга качества воды на основе непрерывного контроля её физических параметров.
Такие исследования могут также привести к созданию новых более эффективных и экономичных методов очистки воды.
Физические параметры воды весьма чувствительны к степени минерализации, примесям и внешним воздействиям, но в наибольшей степени последние влияют на электрическое сопротивление. Если идеально чистая вода является диэлектриком, то реальная вода благодаря растворенным в ней веществам, достаточно хорошо проводит электрический ток. Причем электропроводность воды в зависимости от характера и концентрации примесей, температуры, атмосферного давления может меняться в сотни и тысячи раз.
В связи с этим электропроводность воды может служить удобным параметром для изучения изменений состояния воды, в частности, степени её загрязнения, минерализации, магнитной обработки и т. п. Но для этого необходимо детальное систематическое исследование зависимостей электропроводности разных видов воды от параметров внешней среды, в том числе от температуры, атмосферного давления, электромагнитных полей.
Цель исследования: изучение электропроводности воды в зависимости от степени минерализации, температуры и магнитной обработки.
– выявить характер влияния различных примесей на электропроводность воды (солей, газов, металлов);
– изучить влияние температуры на электропроводность различных видов воды;
– определить характер изменения электропроводности под влиянием градиентного магнитного поля.
Научная новизна проводимых исследований заключается в сравнительном комплексном изучении электропроводности различных видов воды.
Температура и удельная электропроводность воды измерялись с помощью кондуктометра СОМ 100 (рис.17). Погрешность измерения температуры составляла ± 0,1 оС, а удельной электропроводности ± 2% (диапазон измерений 0 – 9990 мкСм/см). Температурная зависимость удельной электропроводности снималась во всех случаях в «динамическом» режиме, то есть измерения проводились при непрерывном изменении температуры.
Выборочно контрольные измерения электропроводности осуществлялись по классической схеме с использованием многопредельного вольтметра и миллиамперметра магнитоэлектрической системы класса точности 0,2 (рис. 18).
Магнитная обработка воды проводилась в слабо неоднородном магнитном поле, которое создавалось двумя пластинами постоянных магнитов SmCo5. Исследуемая вода размещалась в кювете между пластинами и выдерживалась в магнитном поле определенное время. Изменения электропроводности фиксировались в зависимости от времени выдержки в магнитном поле.
Горизонтально направленное магнитное поле в центре между пластинами (т. е. в центре кюветы) составляло 40 мТл и у поверхности пластин (у края кюветы) – 60 мТл. Градиент поля по горизонтали составлял 0,5 мТл/мм. Градиент магнитного поля по вертикали в области нахождения исследуемой воды был близок к нулю.
Измерения магнитного поля осуществлялись измерителем магнитной индукции «Актаком АТЕ–8702». Погрешность измерения магнитной индукции составляла ± 5% (см. рис. 19).
Рис. 17. Кондуктометр для измерения электропроводности и
Рис. 18. Установка по измерению электропроводности воды.
Рис. 19. Измеритель магнитной индукции (Актаком АТЕ-8702).
Объектами исследования были выбраны различные виды воды, представленные в таблице 1.
Влияние температуры на электропроводность полупроводников.
С повышением температуры атомы начинают совершать тепловое колсба-
тельное движение. Энергия атомов передается электронам. Для некоторых электронов этой энергии оказывается достаточно, чтобы оторвать их от своих атомов. Оторвавшийся от своего атома электрон свободно перемещается внутри объема полупроводника (рис. 2,я, 6), т.е. становится свободным носителем тока. Электропроводность полупроводника возрастает, так как увеличивается количество электронов, покидающих связи. Однако общее количество электронов, являющихся свободными носителями тока, остается во много миллионов раз меньше числа атомов. Этим объясняется количественное различие в проводимости полупроводников и металлов.
Рис. 2. Влияние температуры на электропроводность полупроводников
Уход электрона приводит к частичной ионизации двух соседних атомов. Появляющийся при этом единичный положительный заряд, равный по абсолютной величине заряду электрона, относят не к тому или иному атому, а к дефектной связи, оставленной электроном. Такой положительный заряд принято называть дыркой, представляющей собой вакантное место для электрона валентной зоны, а возможно, и зоны проводимости.
Переход элеюрона из заполненной связи в дефектную связь соответствует перемещению дырки в обратном направлении. При отсутствии в кристалле электрического поля процесс заполнения дефектных связей (дырок электронами) носит случайный характер, траектория движения дырки подчиняется законам хаотического движения. Если поместить кристалл в электрическое поле, то дырка будет перемещаться вдоль линий электрического поля. Направленное перемещение дырки (положительного заряда) в электрическом поле есть протекание электрического тока, хотя, строго товоря, носителями заряда являются электроны. Однако практически гораздо удобнее рассматривать непрерывное движение положительного заряда, образующегося в дефектной связи, чем поочередное движение электронов из связи в связь.
Таким образом, нарушение валентной связи за счет тепловой энергии приводит к появлению в кристалле полупроводника двух свободных носителей заряда: отрицательного единичного заряда — электрона, и противоположного ему по знаку положительного единичного заряда — дырки. Электропроводность, возникающая в кристалле полупроводника за счет нарушения валентных связей, называется собственной электропроводностью.
Появление электрона в зоне проводимости и дырки в валентной зоне на энергетической диаграмме представлено на рис. 2,в. Стрелкой условно обозначен переход электрона из валентной зоны в зону проводимости. В валентной зоне осталась дырка.
Влияние примесей на электропроводность полупроводников. Помимо температуры на электропроводность полупроводников в сильной степени влияют принеси. Добавка примеси в полупроводник называется легированием. Рассмотрим два случая.
Введем в структуру идеального полупроводника атом вещества
V группы (например, сурьмы), имеющий во внешней оболочке не четыре, а пять валентных электронов. Пятый электрон в данном случае окажется избыточным и будет значительно слабее связан со своим атомом (рис. 3,я). Для его высвобождения и перевода в зону проводимости (превращения в свободный носитель заряда) требуется значительно меньшее количество энергии AW 7 /;(рис. 3,6), чем ДWдля высвобождения электрона из валентной связи. Поэтому уровни, на которых находятся такие электроны при очень низких температурах, располагаются в запрещенной зоне вблизи от дна зоны проводимости (рис. 3,6), и уже при незначительном повышении температуры они получают количество энергии, достаточное для перехода в зону проводимости. Энергия AWD, затрачиваемая для переброса избыточного электрона в зону проводимости, называется энергией активации примеси.
Уход избыточного электрона превращает атом сурьмы в положительный ион, который будет прочно связан с кристаллической решеткой вещества и нс будет перемещаться подобно дырке. Таким образом, наличие в кристаллической решетке кремния (германия) примесного атома
привело к появлению в зоне проводимости свободного электрона;
=> не оставило дефектной связи (дырки) в валентной зоне.
Следует отметить, что избыточный электрон может занять место дырки в валентной зоне (рис. 3,л).
Рис. 3. Влияние донорных примесей на электропроводность полупроводников
Увеличение примесных атомов сурьмы в кремнии (германии) приводит к повышению концентрации свободных электронов без увеличения количества дырок, как это имело место в случае собственной электропроводности. Когда концентрация электронов значительно превысит концентрацию дырок, электроны становятся основными носителями заряда, а дырки — неосновными. Можно считать, что в таком кристалле ток в основном переносится электронами. Примеси, способные отдавать электроны в зону проводимости, называются донорными примесями, или донорами.
Рассмотрим другой случай, когда в кристаллическую решетку кремния (германия) вводится атом III группы периодической системы элементов, например галлий, внешняя электронная оболочка которого содержит всего три валентных элекгрона. В кристаллической решетке элементов IV группы атом галлия заполняет только три валентные связи, четвертая связь остается незаполненной. Однако незаполненная связь не несет заряда, и атом галлия и смежный с ним атом кремния являются электрически нейтральными. При небольшом тепловом возбуждении электрон одной из соседних заполненных валентных связей или свободный электрон валентной зоны (рис. 4,а) может перейти в эту связь. Во внешней оболочке галлия при этом появляется лишний электрон, атом галлия теряет свою электрическую нейтральность и иревращаегся в отрицательный ион. Нарушается и электрическая нейтральность в той связи, откуда электрон перешел в дефектную связь галлия. В этой связи появляется положительный заряд — дырка. Таким образом, с введением в кремний (германий) примеси III группы повышается концентрация дырок. При достаточной концентрации атомов такой примеси дырки станут основными носителями, а электроны — неосновными носителями.
Рис. 4. Влияние акцепторных примесей на электропроводность полупроводников
Введение атома галлия в решетку элементов IV группы приводит к появлению свободного уровня вблизи от потолка валентной зоны. При низких температурах этот уровень остается свободным. При небольшом повышении температуры один из валентных электронов покидает валентную зону и занимает этот уровень, оставляя после себя в валентной зоне свободный уровень — дырку (рис. 4,6). Примеси, способные принимать на свои уровни валентные электроны, называются акцепторными примесями, или акцепторами.
=> донорные примеси за счет эмиссии электронов с донорных уровней в зону проводимости обеспечивают электронную электропроводность полупроводников. Их называют полупроводниками с электронной электропроводностью, или полупроводниками п-типа (от латинского negative — отрицательный);
=> акцепторные примеси, принимая валентные электроны на акцепторные уровни, приводят к появлению в полупроводниках дырочной электропроводности. Их называют дырочными полупроводниками, или полупроводниками p-типа (от латинского positive — положительный).
Примесная (электронная и дырочная) проводимость обычно значительно превосходит собственную проводимость полупроводника. Избыточные для данного полупроводника носители заряда называются основными, носители заряда противоположного знака — неосновными. В полупроводнике с электронной проводимостью основными носителями заряда являются электроны, в полупроводнике с дырочной проводимостью — дырки.