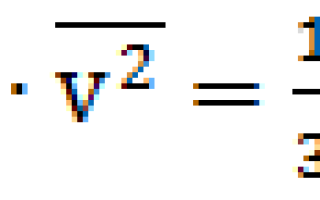Давление газа через концентрацию
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц ( массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м3)
— масса молекулы (кг)
— средний квадрат скорости молекул ( м2/с2)
ρ — плотность газа (кг/м3)
— средняя кинетическая энергия молекул (Дж)
Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
Для того чтоб понять, откуда же у нас получается эта формула, мы выведем среднюю квадратичную скорость молекул. Вывод формулы начинается с основного уравнения молекулярно кинетический теории (МКТ):
Где у нас количество вещества, для более легкого доказательства, возьмем на рассмотрение 1 моль вещества, тогда у нас получается:
Если посмотреть, то PV это две третьих средней кинетической энергии всех молекул (а у нас взят 1 моль молекул):
Тогда, если приравнять правые части, у нас получается, что для 1 моля газа средняя кинетическая энергия будет равняться:
Но средняя кинетическая энергия, так же находится, как :
А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат,Число Авогадро на массу молекулы , получается Молярная масса то у нас и получится формула для средней квадратичной скорости молекулы газа:
А если расписать универсальную газовую постоянную, как , и за одно молярную массу , то у нас получится?
В Формуле мы использовали :
— Средняя квадратичная скорость молекул
— Постоянная Больцмана
— Температура
— Масса одной молекулы
— Универсальная газовая постоянная
— Молярная масса
— Количество вещества
— Средняя кинетическая энергия молекул
— Число Авогадро
Барометрическая формула— определяет зависимость давления или плотности газа от высоты в поле тяжести
Давайте теперь узнаем, откуда же получается барометрическая формула. Давление газа на некой высоте, определяется как :
Теперь возьмем колонну в атмосфере и выделим в ней тонкий слой воздуха высотой dh. Ясно, что такой слой вызывает изменение давления на величину dP :
Знак минус необходим для того, что с увеличением высоты давление уменьшается
Рассматривая атмосферный воздух как идеальный газ, можно воспользоваться уравнением Менделеева — Клапейрона
Из этого уравнения выражаем давление
А теперь можно и плотность газа
Подставляя найденную плотность газа в дифференциальное уравнение dP, мы получаем :
Сделав все преобразования. мы получаем зависимость давления P от высоты подъема h. Теперь необходимо проинтегрировать обе части нашего уравнения:
Проинтегрировав, у нас полечилась вот такое уравнение:
И теперь последний рывок, это взять логарифм. И у нас получится Барометрическое уравнение.
В Формуле мы использовали :
— Давление газа (атмосферное)
— Давление газа над уровнем моря
— Высота над уровнем моря
— Плотность газа
— Ускорение свободного падения
— Постоянная Больцмана
— Температура
— Масса одной молекулы
— Универсальная газовая постоянная
— Молярная масса
— Количество вещества
— Число Авогадро
Ма́ксвелла распределе́ние, распределение по скоростям частиц (молекул) макроскопической физической системы, находящейся в состоянии термодинамического равновесия, (в отсутствии внешнего поля, при условии, что движение частиц подчиняется законам классической механики. Установлено Дж. К. Максвеллом в 1859.
Закон Максвелла о распределении молекул идеального газа по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
Функция распределения молекул по скоростям f(v)=dN(v)/Ndv определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv и имеет смысл плотности вероятности.
Для газа, подчиняющегося классической механике, в состоянии статистического равновесия функция распределения f Максвелла по скоростям имеет вид:
f(v) =n(m/2pkT) 3/2 exp(-mv 2 /2kT),
Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Значение функции распределения f(v) зависит от рода газа (от массы молекул) и от температуры.
С помощью распределения Максвелла можно вычислять средние значения скоростей молекул и любых функций этих скоростей. В частности, средняя квадратичная скорость v 2 =3kT/m, а средняя скорость молекулы v = (8kT/pm) 1/2 .
Распределение Максвелла не зависит от взаимодействия между молекулами и справедливо не только для газов, но и для жидкостей, если для них возможно применить классическое описание.
Распределение Максвелла вытекает из Гиббса распределения канонического в том случае, когда поступательное движение частиц можно рассматривать в классическом приближении, учитывая, что распределение по скоростям не зависит от распределения по пространственным координатам. Распределение Максвелла является частным решением кинетического уравнения Больцмана для случая статистического равновесия в отсутствии внешних полей. Распределение Максвелла не зависит от характера взаимодействия частиц системы и от внешних сил и потому справедливо как для молекул газа, так и для молекул жидкостей и твердых тел. Распределение Максвелла справедливо также для случая броуновского движения частиц, взвешенных в газе или жидкости.
93.79.221.197 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Давление газа
Разделив левую и правую части уравнения (4.4.8) на SΔt и учитывая соотношение (4.3.6), найдем давление газа
(4.4.9)
Это и есть основное уравнение молекулярно-кинетической теории идеального газа*.
* Это уравнение — первое количественное соотношение, полученное в молекулярно-кинетической теории. Поэтому его принято называть основным.
Давление идеального газа пропорционально произведению массы молекулы на концентрацию молекул и средний квадрат их скорости.
Формула (4.4.9) связывает макроскопическую величину — давление, которое может быть измерено манометром, — с микроскопическими величинами, характеризующими молекулы, и является как бы мостом между двумя мирами: макроскопическим и микроскопическим.
Если через обозначить среднюю кинетическую энергию поступательного движения молекулы: , то уравнение (4.4.9) можно записать в форме:
(4.4.10)
Отметим в заключение, что хотя расчет произведен без явного учета столкновений молекул, это не означает, что столкновения совсем не учитывались нами. Именно огромное число столкновений приводит к тому, что движение молекул является хаотическим. Равенства (4.3.4) и (4.3.6) выполняются с большой точностью как раз вследствие громадного числа столкновений.
Нам удалось вычислить давление идеального газа на стенки сосуда. Оно зависит от концентрации молекул. Кроме того, давление газа пропорционально средней кинетической энергии молекул. Это и есть главный факт.
§ 4.5. Температура— мера средней кинетической энергии молекул
Из основного уравнения молекулярно-кинетической теории газа вытекает важное следствие: температура есть мера средней кинетической энергии молекул. Докажем это.
Для простоты будем считать количество газа равным 1 моль. Молярный объем газа обозначим через VM. Произведение молярного объема на концентрацию молекул представляет собой постоянную Авогадро NA, т. е. число молекул в 1 моль.
(4.5.1)
Формула (4.5.1) устанавливает связь макроскопических параметров — давления р и объема VM — со средней кинетической энергией поступательного движения молекул.
Вместе с тем полученное опытным путем уравнение состояния идеального газа для 1 моль имеет вид:
(4.5.2)
Левые части уравнений (4.5.1) и (4.5.2) одинаковы, значит, должны быть равны и их правые части, т. е.
Отсюда вытекает связь между средней кинетической энергией поступательного движения молекул и температурой:
(4.5.3)
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре. Чем выше температура, тем быстрее движутся молекулы.
Соотношение между температурой и средней кинетической энергией поступательного движения молекул (4.5.3) установлено для разреженных газов. Однако оно оказывается справедливым для любых веществ, движение атомов или молекул которых подчиняется законам механики Ньютона. Оно верно для жидкостей, а также для твердых тел, у которых атомы могут лишь колебаться возле положений равновесия в узлах кристаллической решетки.
При приближении температуры к абсолютному нулю энергия теплового движения молекул также приближается к нулю*.
* При очень низких температурах (вблизи абсолютного нуля) движение атомов и молекул уже не подчиняется законам Ньютона. Согласно более точным законам движения микрочастиц — законам квантовой механики — абсолютный нуль соответствует минимальному значению энергии движения, а не полному прекращению какого-либо движения вообще.
Идеальный газ. Формула концентрации молекул газа. Пример задачи
В физике текучих субстанций большое внимание уделяется изучению газов, которое осуществляют при помощи использования модели идеального газа. В этой области было открыто много законов. В приведенной ниже статье изучим формулу концентрации молекул газа (идеального) и покажем, как ее следует применять при решении практической проблемы.
Идеальный газ
Что же это такое? Прежде чем записать формулу концентрации молекул газа, расскажем, что собой представляет модель идеального газа. В соответствии с кинетической теорией текучих субстанций, в таких веществах молекулы и атомы движутся хаотически по прямым траекториям. Расстояния между ними намного больше, чем их собственные линейные размеры, поэтому последними пренебрегают при выполнении вычислений. Кроме того, считают, что взаимодействий между молекулами не существует, поскольку их кинетическая энергия слишком велика по сравнению со слабыми потенциальными взаимодействиями.
Любые реальные газы, которые находятся при низких давлениях и достаточно высоких абсолютных температурах, по своему поведению приближаются к описанной модели. Тем не менее существуют текучие субстанции, у которых помимо ван-дер-ваальсовых взаимодействий между частицами действуют взаимодействия более сильного характера. Примером является водяной пар, у которого молекулы друг с другом связаны водородными (полярными) связями. Для описания поведения таких субстанций нельзя использовать модель идеального газа.
Универсальное уравнение
Модель идеального газа удобна при выполнении практических расчетов тем, что уравнение состояния вещества, полученное на ее основе, связывает три термодинамических параметра: температуру T, объем системы V и абсолютное давление P. Это уравнение записано ниже:
Где R — постоянная, равная 8,314 Дж/(моль*К), n — количество вещества.
Современная молекулярно-кинетическая теория газов позволяет путем несложных рассуждений и математических выкладок получить теоретически это уравнение. Впервые же оно было записано в результате анализа многочисленных экспериментов, которые в течение двух веков выполняли европейские ученые, начиная от Роберта Бойля (вторая половина XVII века) и заканчивая Амедео Авогадро (начало XIX века).
Считается, что уравнение состояния идеального газа первым получил Эмиль Клапейрон, а к современной форме его привел русский химик Дмитрий Менделеев, поэтому его часто называют законом Клапейрона-Менделеева.
Понятие о концентрации молекул: виды концентраций
Когда изучают текучие субстанции, то знать концентрации компонентов, которые их образуют, является важным при решении многих практических задач. Например, от этого показателя и размеров молекул зависит общая площадь поверхности активного вещества, а значит, его реакционная способность. Другой пример, концентрация некоторых веществ в воздухе определяет допустимые их пределы для нормального протекания жизненно необходимых процессов в организме человека.
В случае газов, как правило, пользуются тремя следующими концентрациями:
- Атомная. Она определяется, как процентное содержание количества атомов или молекул компонента по отношению к объему всей системы.
- Массовая. Показывает отношение массы компонента к объему газа.
- Молярная. Она равна отношению количества вещества изучаемого компонента к объему системы.
Заметим, что все виды концентраций вычисляются по отношению к объему системы. Справедливость этих величин действительна, поскольку каждый компонент системы полностью заполняет ее объем.
Среди всех типов концентраций наиболее удобной на практике является молярная. Ниже в статье приведем формулу именно для нее.
Формула концентрации молекул газа
В соответствии с приведенным в предыдущем пункте определением, молярная концентрация i-го компонента системы cn(i) вычисляется так:
Предположим, что мы имеем однокомпонентный (чистый) газ. Это может быть кислород, азот, гелий и так далее. В этом случае можно применить формулу Клапейрона-Менделеева и выразить из нее молярную концентрацию молекул. Имеем:
cn = n / V = P / (R * T).
Из записанной формулы концентрации молекул газа легко получить атомную (молекулярную) концентрацию. Покажем, как это делается:
Здесь NA и kB — число Авогадро и постоянная Больцмана. Соответственно, N — число молекул в системе. Поскольку величина kB имеет маленькое значение (1,38 * 10 -23 ), то cN принимает огромные значения, что неудобно для ее практического использования.
Пример задачи
В результате изобарного нагрева закрытой системы с идеальным газом его температура увеличилась на 100 К и стала равной 400 К. Как изменится концентрация молекул газа, если давление в системе составляет 1,5 атмосферы.
Поскольку давление в процессе нагрева не изменилось, а температура была равна 300 К согласно условию задачи, то молярная концентрацию молекул до нагрева системы составляла:
cn1 = 1,5 * 101 325 / (8,314 * 300) = 60,9 моль/м 3 .
Число молекул в системе не изменилось при нагреве, так как система является закрытой. После нагрева газа его концентрация составила:
cn2 = 1,5 * 101 325 / (8,314 * 400) = 45,7 моль/м 3 .
Изменение концентрации составило:
Отрицательный знак говорит, что концентрация уменьшилась, что является очевидным, поскольку увеличился объем системы после нагрева, а число частиц в ней осталось прежним.
Давление газа — формула. Формула давления газа в сосуде
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия — упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 10 23 ), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния
В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
Объем сосуда в кубических метрах равен 0,01 м 3 . Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Давление газа через концентрацию
Уравнение состояния. Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (формула 2.10). На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра , характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа Подставим в уравнение выражение для концентрации газа. Учитывая формулы (1.3) и (1.7), концентрацию газа можно представить следующим образом:
где — постоянная Авогадро, — масса газа, М — его молярная масса.
После подстановки (3.1) в (2.10) будем иметь:
Произведение постоянной Больцмана и постоянной Авогад называют универсальной газовой постоянной и обозначают буквой
Подстаьляя в уравнение (3.2) вместо произведения универсальную газовую постоянную получим уравнение состояния для произвольной массы идеального газа:
Единственная величина в этом уравнении, зависящая от рода газа, — это его молярная масса.
Из уравнения состояния (3.4) вытекает связь между давлением, объемом и температурой идеального газа в двух любых состояниях.
Если индексом обозначить параметры, относящиеся к первому состоянию, а индексом 2 — параметры, относящиеся ко второму состоянию, то согласно уравнению (3.4) для данной массы газа
Правые части этих уравнений одинаковы. Следовательно, должны быть равны и их левые части:
Уравнение состояния в форме (3.5) ност название уравнения Клапейрона и представляет собой одну из форм записи уравнения состояния.
Уравнение состояния в форме (3.4) было Епервые получено великим русским ученым Д. И. Менделеевым. Поэтому его называют уравнением Менделеева — Клапейрона.
Экспериментальная проверка уравнения состояния. В справедливости уравнения состояния в форме (3.5) можно убедиться с помощью прибора, изображенного на рисункь 31.
Герметический гофрированный сосуд соединен с манометром М, регистрирующим давление внутри сосуда. При вращении винта В объем сосуда меняется. Об объеме можно судить с помощью линейки Л. Температура газа в сосуде равна температуре окружающего воздуха и регистрируется термометром.
Измеряя давление температуру Т и объем V газа в начальном состоянии (рис. 31, а), можно вычислить отношение (надо помнить, что Т — это абсолютная температура, а не температура по шкале Цельсия).
После этого нужно изменить объем сосуда и нагреть газ, поместив сосуд в горячую воду (рис. 31, б). Измерив снова давление газа объем и температуру можно вычислить отношение
В пределах точности, обеспечиваемой экспериментальной установкой, уравнение состояния (3.5) выполняется. Лишь при давлениях в тысячи атмосфер отклонения результатов эксперимента от предсказываемых уравнением состояния идеального газа, становятся существенными. Плотные газы нельзя даже приближенно считать идеальными.